Tìm kiếm phương trình hóa học
Hãy nhập vào chất tham gia hoặc/và chất sản phẩm để bắt đầu tìm kiếm
Những Điều Thú Vị Chỉ 5% Người Biết
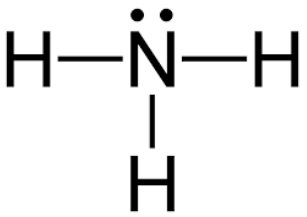
H2 + N2 → NH3 | Cân Bằng Phương Trình Hóa Học
H2 | hidro | Khí + N2 | nitơ | khí = NH3 | amoniac | Khí, Điều kiện Nhiệt độ 500, Áp Xuất 500, Chất xúc tác Fe, Pt, Tỏa nhiệt và xuất hiện khí mùi khai Amoniac (NH3)., Đặc điểm của phản ứng này là tốc độ rất chậm ở nhiệt độ thường, toả nhiệt và số mol khí của sản phẩm ít hơn so với số mol khí của các chất phản ứng. do đó, người ta phải thực hiện phản ứng này ở nhiệt độ cao, áp suất cao và dung chất xúc tác. Ở áp suất cao, cân bằng chuyển dịch sang phía tạo ra NH3, nhưng ở nhiệt độ cao, cân bằng chuyển dịch ngược lại, nên chỉ thực hiện được ở nhiệt độ thích hợp.
Giới thiệu
Thông tin chi tiết về phương trình
Điều kiện phản ứng khi cho tác dụng H2 + N2
- Chất xúc tác: không có
- Nhiệt độ: 500
- Áp suất: áp suất
- Điều kiện khác: Fe, Pt
Quá trình phản ứng H2 + N2
Quá trình: đang cập nhật...
Lưu ý: Đặc điểm của phản ứng này là tốc độ rất chậm ở nhiệt độ thường, toả nhiệt và số mol khí của sản phẩm ít hơn so với số mol khí của các chất phản ứng. do đó, người ta phải thực hiện phản ứng này ở nhiệt độ cao, áp suất cao và dung chất xúc tác. Ở áp suất cao, cân bằng chuyển dịch sang phía tạo ra NH3, nhưng ở nhiệt độ cao, cân bằng chuyển dịch ngược lại, nên chỉ thực hiện được ở nhiệt độ thích hợp.
Hiện tượng xảy ra sau phản ứng H2 + N2
Hiện tượng: Tỏa nhiệt và xuất hiện khí mùi khai Amoniac (NH3).
Thông tin chi tiết các chất tham gia phản ứng
Thông tin về H2 (hidro)
- Nguyên tử khối: 2.01588 ± 0.00014
- Màu sắc: không màu, sẽ phát sáng với ánh sáng tím khi chuyển sang thể plasma
- Trạng thái: Khí
Một số người coi khí hydro là nhiên liệu sạch của tương lai - được tạo ra từ nước và trở lại nước khi nó bị oxy hóa. Pin nhiên liệu chạy bằng hydro ngày càng được coi là nguồn năng lượng 'không gây ô nhiễm' và hiện đang được sử dụng trong một số xe buýt và ô tô. Hydro còn có nhiều công dụng khác....
Thông tin về N2 (nitơ)
- Nguyên tử khối: 28.01340 ± 0.00040
- Màu sắc: không màu
- Trạng thái: khí

1. Hợp chất nitơ Phân tử nitơ trong khí quyển là tương đối trơ, nhưng trong tự nhiên nó bị chuyển hóa rất chậm thành các hợp chất có ích về mặt sinh học và công nghiệp nhờ một số cơ thể sống, chủ yếu là các vi khuẩn (xem Vai trò sinh học dưới đây). Khả năng kết hợp hay cố định nitơ là đặc trưng qua...
Thông tin chi tiết các chất sản phẩm sau phản ứng
Thông tin về NH3 (amoniac)
- Nguyên tử khối: 17.03052 ± 0.00041
- Màu sắc: Không màu
- Trạng thái: Khí
Amoniac , còn được gọi là NH 3 , là một chất khí không màu, có mùi đặc biệt bao gồm các nguyên tử nitơ và hydro. Nó được tạo ra một cách tự nhiên trong cơ thể con người và trong tự nhiên — trong nước, đất và không khí, ngay cả trong các phân tử vi khuẩn nhỏ. Đối với sức khỏe con người, amoniac và io...
Tổng số đánh giá:
Xếp hạng: / 5 sao
Các phương trình điều chế H2
Chất xúc tác
thường
Nhiệt độ
thường
Áp suất
thường
Điều kiện khác
thường
Chất xúc tác
thường
Nhiệt độ
temperature
Áp suất
thường
Điều kiện khác
thường
Chất xúc tác
thường
Nhiệt độ
thường
Áp suất
thường
Điều kiện khác
thường
Các phương trình điều chế N2
→ 4 + +
Chất xúc tác
thường
Nhiệt độ
168 - 185
Áp suất
thường
Điều kiện khác
thường
Chất xúc tác
thường
Nhiệt độ
thường
Áp suất
thường
Điều kiện khác
thường
Chất xúc tác
thường
Nhiệt độ
temperature
Áp suất
thường
Điều kiện khác
thường
Một số định nghĩa cơ bản trong hoá học.
Mol là gì?
Trong hóa học, khái niệm mol được dùng để đo lượng chất có chứa 6,022.10²³ số hạt đơn vị nguyên tử hoặc phân tử chất đó. Số 6,02214129×10²³ - được gọi là hằng số Avogadro.
Xem thêmĐộ âm điện là gì?
Độ âm điện là đại lượng đặc trưng định lượng cho khả năng của một nguyên tử trong phân tử hút electron (liên kết) về phía mình.
Xem thêmKim loại là gì?
Kim loại (tiếng Hy Lạp là metallon) là nguyên tố có thể tạo ra các ion dương (cation) và có các liên kết kim loại, và đôi khi người ta cho rằng nó tương tự như là cation trong đám mây các điện tử.
Xem thêmNguyên tử là gì?
Nguyên tử là hạt nhỏ nhất của nguyên tố hóa học không thể chia nhỏ hơn được nữa về mặt hóa học.
Xem thêmPhi kim là gì?
Phi kim là những nguyên tố hóa học dễ nhận electron; ngoại trừ hiđrô, phi kim nằm bên phải bảng tuần hoàn.
Xem thêmNhững sự thật thú vị về hoá học có thể bạn chưa biết
Sự thật thú vị về Hidro
Hydro là nguyên tố đầu tiên trong bảng tuần hoàn. Nó là nguyên tử đơn giản nhất có thể bao gồm một proton trong hạt nhân được quay quanh bởi một electron duy nhất. Hydro là nguyên tố nhẹ nhất trong số các nguyên tố và là nguyên tố phong phú nhất trong vũ trụ.
Xem thêmSự thật thú vị về heli
Heli là một mặt hàng công nghiệp có nhiều công dụng quan trọng hơn bong bóng tiệc tùng và khiến giọng nói của bạn trở nên vui nhộn. Việc sử dụng nó là rất cần thiết trong y học, khí đốt cho máy bay, tên lửa điều áp và các tàu vũ trụ khác, nghiên cứu đông lạnh, laser, túi khí xe cộ, và làm chất làm mát cho lò phản ứng hạt nhân và nam châm siêu dẫn trong máy quét MRI. Các đặc tính của heli khiến nó trở nên không thể thiếu và trong nhiều trường hợp không có chất nào thay thế được heli.
Xem thêmSự thật thú vị về Lithium
Lithium là kim loại kiềm rất hoạt động về mặt hóa học, là kim loại mềm nhất. Lithium là một trong ba nguyên tố được tạo ra trong BigBang! Dưới đây là 20 sự thật thú vị về nguyên tố Lithium - một kim loại tuyệt vời!
Xem thêmSự thật thú vị về Berili
Berili (Be) có số nguyên tử là 4 và 4 proton trong hạt nhân của nó, nhưng nó cực kỳ hiếm cả trên Trái đất và trong vũ trụ. Kim loại kiềm thổ này chỉ xảy ra tự nhiên với các nguyên tố khác trong các hợp chất.
Xem thêmSự thật thú vị về Boron
Boron là nguyên tố thứ năm của bảng tuần hoàn, là một nguyên tố bán kim loại màu đen. Các hợp chất của nó đã được sử dụng hàng nghìn năm, nhưng bản thân nguyên tố này vẫn chưa bị cô lập cho đến đầu thế kỉ XIX.
Xem thêmSo sánh các chất hoá học phổ biến.
HfO2.nH2O và Rb2CO3.1,5H2O
Điểm khác nhau về tính chất vật lý, hoá học giữa chất Hafni dioxit hidrat và chất Rubidi cacbonat sesquihidrat
Xem thêmRbIF4 và RbSO2F
Điểm khác nhau về tính chất vật lý, hoá học giữa chất Rubidi tetraflorua iodua và chất Rubidi florosunfit
Xem thêm[IF6][AuF6] và UF4.2,5H2O
Điểm khác nhau về tính chất vật lý, hoá học giữa chất Hexafluoroiodine hexafluoroaurate và chất Urani(IV) florua 2,5 hidrat
Xem thêmUF4.H2O và K[PtF6]
Điểm khác nhau về tính chất vật lý, hoá học giữa chất Urani(IV) floua monohidrat và chất Kali hexafloroplatinat(V)
Xem thêmLiên Kết Chia Sẻ
** Đây là liên kết chia sẻ bới cộng đồng người dùng, chúng tôi không chịu trách nhiệm gì về nội dung của các thông tin này. Nếu có liên kết nào không phù hợp xin hãy báo cho admin.
Khám Phá Tin Tức Thú Vị Chỉ 5% Người Biết
Cập Nhật 25/04/2024



